Железодефицитная анемия при хпн
Содержание
Железодефицитная анемия, симптомы и лечение – Сайт о

Железодефицитная анемия – клинико-гематологический синдром, обусловленный недостатком железа в организме человека, что влечет нарушение нормального синтеза гемоглобина и гипоксию тканей.
Железодефицитная анемия обусловлена недостатком железа в организме человека
Патология широко распространена. По статистическим данным, у 8-10% женщин детородного возраста диагностируется железодефицитная анемия, а у 30% женщин – латентный дефицит железа. В раннем детском возрасте признаки железодефицитной анемии выявляются у каждого второго ребенка. В структуре всех анемий на долю железодефицитной приходится 90%.
Причины и факторы риска
В основе развития железодефицитной анемии лежит отрицательный баланс обмена железа. К этому могут приводить разные факторы, но чаще всего причиной дефицита железа становится хроническая кровопотеря:
- кровотечения из геморроидальных узлов или анальных трещин;
- дисфункциональные маточные кровотечения;
- обильные менструации;
- желудочно-кишечные кровотечения (из эрозий и язв слизистой оболочки желудка или кишечника).
Другие причины кровопотери:
- гельминтозы;
- гемосидероз легких;
- геморрагические диатезы (болезнь Виллебранда, гемофилия);
- гемоглобинурия;
- обширные травмы и операции;
- частая сдача крови (донорство).
Нередко железодефицитная анемия развивается и у пациентов с хронической почечной недостаточностью, находящихся на программном гемодиализе.
При железодефицитных состояниях происходит снижение активности IgA; в результате у пациентов зачастую возникают кишечные и респираторные инфекции.
Недостаток железа в организме также может сформироваться в результате недостаточного поступления его из пищи по следующим причинам:
- низкий уровень жизни;
- вегетарианство;
- соблюдение диеты, ограничивающей употребление мясных продуктов;
- анорексия;
- искусственное вскармливание детей грудного возраста, особенно при позднем введении прикорма.
Ряд заболеваний и патологических состояний органов пищеварительной системы может приводить к нарушению всасывания железа и развитию железодефицитной анемии:
- гастерэктомия;
- состояние после резекции тонкой кишки;
- синдром мальабсорбции;
- хронический энтерит;
- гипоацидный гастрит;
- кишечные инфекции.
Железодефицитная анемия развивается и у пациентов, страдающих хроническими гепатитами или циррозом печени. В данном случае нарушается транспорт железа из депо.
Причиной развития анемии может быть нарушение всасывания и метаболизма железа
Железодефицитная анемия может также появиться на фоне повышенной потребности в железе (в период полового созревания, беременности либо лактации) или при значительных потерях этого элемента (при онкологических, инфекционных заболеваниях).
Формы заболевания
В зависимости от причины железодефицитные анемии делятся следующим образом:
- алиментарные;
- постгеморрагические;
- связанные с нарушением транспорта железа, недостаточностью его резорбции или повышенным расходом;
- обусловленные врожденным (исходным) дефицитом железа.
По степени выраженности лабораторных и клинических признаков железодефицитные анемии бывают:
- легкими (гемоглобин выше 90 г/л);
- средней тяжести (гемоглобин от 70 до 90 г/л);
- тяжелыми (гемоглобин менее 70 г/л).
Железодефицитная анемия легкой степени в большинстве случаев протекает без-каких либо клинических проявлений или с минимальной их выраженностью. Тяжелая форма сопровождается развитием гематологического, сидеропенического и циркуляторно-гипоксического синдромов.
Стадии заболевания
В течении железодефицитной анемии выделяют несколько стадий:
- Предлатентный железодефицит – истощается депонированное железо, гемоглобиновые и транспортные запасы сохранены.
- Латентный железодефицит – происходит снижение запасов содержащегося в плазме крови транспортного железа.
- Собственно железодефицитная анемия – истощение всех метаболических запасов железа (эритроцитарного, транспортного и депонированного).
Симптомы
В клинической картине железодефицитной анемии выделяют синдромы:
- циркуляторно-гипоксический;
- сидеропенический;
- астеновегетативный.
Возникающие на фоне железодефицитной анемии циркуляторно-гипоксические нарушения ухудшают течение сопутствующих заболеваний сердечно-сосудистой и дыхательных систем.
Развитие циркуляторно-гипоксического синдрома обусловлено нарушением синтеза гемоглобина, в результате чего страдает транспорт кислорода и развивается тканевая гипоксия. Клинически это проявляется:
- общей слабостью;
- сонливостью;
- головокружениями;
- шумом в ушах;
- преходящими обмороками;
- учащенным сердцебиением;
- повышенной чувствительностью к низкой температуре;
- одышкой, возникающей при физических нагрузках, а при тяжелой анемии – и в состоянии покоя.
Общая слабость, сонливость, обмороки – симптомы железодефицитной анемии
Механизм развития сидеропенического синдрома связан с дефицитом железосодержащих тканевых ферментов (цитохромов, пероксидазы, каталазы). Недостаток названных ферментов становится причиной наблюдаемых на фоне железодефицитной анемии трофических расстройств со стороны слизистых оболочек и кожных покровов. Признаки сидеропенического синдрома:
- сухость кожи;
- деформация, повышенная ломкость и поперечная исчерченность ногтей;
- выпадение волос;
- атрофический гастрит;
- дисфагия;
- ангулярный стоматит;
- глоссит;
- искажения вкуса (желание употреблять в пищу несъедобные предметы, например глину или зубной порошок);
- дизурические расстройства;
- диспепсия;
- мышечная слабость.
Астеновегетативный синдром характеризуется эмоциональной лабильностью, повышенной раздражительностью, ухудшением памяти, снижением работоспособности.
Особенности протекания заболевания у детей
Клиническая картина железодефицитной анемии у детей неспецифична, преобладает один из следующих синдромов:
- Астеновегетативный. Связан с кислородным голоданием тканей нервной системы. Проявляется снижением мышечного тонуса и задержкой психомоторного развития ребенка. При тяжелой степени железодефицитной анемии и отсутствии необходимой терапии возможна интеллектуальная недостаточность. К другим проявлениям астеновегетативного синдрома относят энурез, обморочные состояния, головокружение, раздражительность и плаксивость.
- Эпителиальный. Характеризуется изменениями со стороны кожи и ее придатков. Кожные покровы становятся сухими, в области коленей и локтей развивается гиперкератоз, волосы теряют блеск и активно выпадают. Часто развиваются хейлит, глоссит, ангулярный стоматит.
- Диспепсический. Снижается аппетит вплоть до полного отказа от еды, наблюдаются неустойчивость стула (поносы, чередующиеся с запорами), вздутие живота, дисфагия.
- Сердечно-сосудистый. Развивается на фоне тяжелой железодефицитной анемии и проявляется одышкой, снижением артериального давления, тахикардией, шумами в сердце и дистрофическими изменениями в миокарде.
- Синдром иммунодефицита. Характеризуется немотивированным повышением температуры до субфебрильных значений. Дети подвержены респираторным кишечным инфекциям с тяжелым и (или) затяжным течением.
- Гепатолиенальный. Наблюдается на фоне выраженной железодефицитной анемии, особенно сочетающейся с другими видами анемий или рахитом. Проявляется увеличением размеров печени и селезенки.
В раннем детском возрасте признаки железодефицитной анемии выявляются у каждого второго ребенка.
- Детское вегетарианство: польза или вред для здоровья?
- Анорексия и булимия: 9 мифов о расстройствах пищевого поведения
- 8 вредных для здоровья способов употребления чая
Диагностика
Диагностика состояния, а также определение степени его тяжести осуществляются по результатам лабораторных исследований. Для железодефицитной анемии характерны следующие изменения:
- снижение содержания гемоглобина в крови (норма для женщин – 120–140 г/л, для мужчин – 130–150 г/л);
- пойкилоцитоз (изменение формы эритроцитов);
- микроцитоз (наличие в крови аномально маленьких по своим размерам эритроцитов);
- гипохромия (цветовой показатель – менее 0,8);
- снижение концентрации сывороточного железа (норма для женщин – 8,95–30,43 мкмоль/л, для мужчин – 11,64–30,43 мкмоль/л);
- уменьшение концентрации ферритина (норма для женщин – 22–180 мкг/л, для мужчин – 30–310 мкг/л);
- уменьшение насыщения трансферрина железом (норма – 30%).
Диагноз «железодефицитная анемия» ставится на основе определения уровня гемоглобина в крови
Для эффективного лечения железодефицитной анемии важно установить причину, ее вызвавшую. С целью обнаружения источника хронической кровопотери показано проведение:
- ФЭГДС;
- рентгенографии желудка с контрастированием;
- колоноскопии;
- ирригоскопии;
- ультразвукового исследования органов малого таза;
- исследования кала на скрытую кровь.
По статистическим данным, у 8-10% женщин детородного возраста диагностируется железодефицитная анемия, а у 30% женщин – латентный дефицит железа.
В сложных диагностических случаях выполняют пункцию красного костного мозга с последующим гистологическим и цитологическим исследованием полученного пунктата. Значительное снижение в нем сидеробластов свидетельствует о наличии железодефицитной анемии.
Дифференциальная диагностика проводится с другими видами гипохромных анемий (талассемией, сидеробластной анемией).
Лечение
Принципы терапии железодефицитной анемии:
- устранение источника хронической кровопотери;
- коррекция рациона;
- восполнение недостатка железа.
Важную роль играет диетотерапия. В рацион включают язык, печень, мясо кролика, баранину, говядину, телятину – продукты, богатые гемовым железом.
Для улучшения всасывания железа из желудочно-кишечного тракта необходимы аскорбиновая, янтарная и лимонная кислоты, которые в большом количестве содержатся в свежих фруктах и ягодах.
Исключают шоколад, молоко, соевый протеин, чай, кофе, поскольку они ингибируют всасывание железа.
Нужно есть продукты, богатые железом
Но только лишь диетой восполнить уже образовавшийся дефицит железа невозможно. Пациенты с железодефицитной анемией проходят заместительную терапию ферропрепаратами длительным курсом (не менее 2-2,5 месяцев).При тяжелой форме железодефицитной анемии и выраженном циркуляторно-гипоксическом синдроме возникают показания к проведению гемотрансфузии.
Возможные осложнения и последствия
- Возникающие на фоне железодефицитной анемии циркуляторно-гипоксические нарушения ухудшают течение сопутствующих заболеваний сердечно-сосудистой и дыхательных систем.
- При железодефицитных состояниях происходит снижение активности IgA; в результате у пациентов зачастую возникают кишечные и респираторные инфекции.
- На фоне длительного течения тяжелой формы железодефицитной анемии у больных может развиться миокардиодистрофия.
Прогноз
Прогноз благоприятный при условии своевременной коррекции дефицита железа и устранения причины развития анемии.
Профилактика
Профилактика железодефицитной анемии включает:
- полноценное рациональное питание;
- ежегодный контроль содержания гемоглобина в крови;
- своевременное устранение источников хронической кровопотери;
- профилактический прием препаратов железа лицами из группы риска.
с по теме статьи:
Источник:
“Железодефицитная анемия у женщин — особенности развития, симптомы и лечение”
Само понятие анемия отображает патологические изменения в составе крови — снижение концентрации белкового компонента (гемоглобина) и красных кровяных клеток (гематокритов), уровень которых зависит от объема и количества форменных элементов крови – эритроцитов. Анемию нельзя назвать заболеванием, она является лишь симптомом различных патологических нарушений, развивающихся внутри организма.
В медицинских кругах анемию называют синдромом усталости. Этот термин объединяет целую группу гематологических синдромов, объединенных общими признаками – патологическими изменениями в структуре крови.
Что это за болезнь?
Эти «тарелочки» — это эритроциты в составе крови
Железодефицитная анемия — это одна из форм анемии, проявляющаяся вследствие нарушений в этапах белкового синтеза и дисбаланса в крови железа, вызванного нарушениями в системе метаболизма. Железо жизненно необходимо организму, и является важной составляющей гемоглобина, позволяя ему переносить кислород.
Циркулируя по крови в составе эритроцитов, гемоглобин соединяется с кислородом (в легких) и доставляет его в различные клетки и ткани (отдаёт). Если организм получает недостаточное количество минералов железа, процесс газообмена — транспортировки кислорода к тканевым структурам и выведение из них углекислого газа — нарушается. Это приводит к постепенному развитию анемии.
Даже при достаточном количестве эритроцитов в крови, при железодефицитной анемии они не способны обеспечить тканевое дыхание — из-за низкой концентрации железа в своём составе. Вследствие чего, в различных системах и органах развивается тканевая гипоксия.
У человека (с примерным весом в 70 кг.) оптимальный уровень железа в организме должен поддерживаться в количестве не меньшем, чем 4-е гр. Это количество сохраняется благодаря четкому регулированию баланса поступления микроэлемента и его потерей.
Для сохранения равновесия человек (в течение суток) должен получать от 20 до 25 мг. железа.
Источник: https://mc-expert.ru/kozhnye-pryshhi/zhelezodefitsitnaya-anemiya-simptomy-i-lechenie.html
Анемия при хронической почечной недостаточности

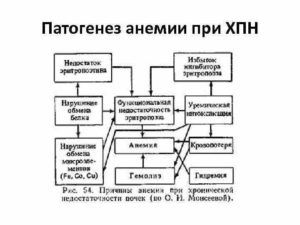
Хронические заболевания почек характеризуются неприятной симптоматикой. Анемия при ХПН не является редкостью. Она возникает по причине снижения уровня железа, недостаточного количества эритропоэтина.
Основные причины анемии при заболеваниях почек
При хронической почечной недостаточности развивается нефрогенная анемия. Ее основные признаки по сути такие же, как и при обычном малокровии – снижение уровня гемоглобина крови, эритроцитов.
Главным триггерным фактором процесса служит уменьшение продукции эритропоэтина. Ситуация встречается при нарушении работы почек, когда падает скорость клубочковой фильтрации. Интоксикация при хронической патологии почек, почечной недостаточности также замедляет синтез этого гормона.
Число эритроцитов также сокращается по причине нарушения гомеостаза, когда в организме накапливаются кислоты. На поздних стадиях хронической почечной недостаточности (ХПН) проводится гемодиализ, который способствует очистке крови от вредных веществ.Если сочетается эта патология со снижением усвоения организмом железа, витамина В12 или фолиевой кислоты, продукция эритроцитов также нарушается. Такая ситуация возможна при заболеваниях почек, поскольку поздние стадии характеризуются повреждением слизистой оболочки кишечника, нарушением всасывания необходимых продуктов, развивается дефицит железа, прогрессирует анемия.
Симптомы нефрогенной анемии
Эта патология влияет на работу всех органов и систем организма. Клиническая картина анемии при почечной недостаточности манифестирует не сразу по причине медленного течения. На первых этапах несколько снижается артериальное давление, а затем встречаются:
- общие симптомы – слабость, головные боли;
- повышенная раздражительность;
- снижение аппетита;
- нарушение сна.
При прогрессе почечной недостаточности возникают различные патологии сердечно-сосудистой системы. Больные ХПН страдают от одышки при незначительной нагрузке, тахикардии, развивается выраженная гипертрофия миокарда. Развитие железодефицита, нарушение синтеза эритропоэтина приводит к усугублению сердечной недостаточности. Отмечается бледность кожных покровов.
Угнетается работа центральной нервной системы. Хроническая недостаточность почек с анемией провоцируют развитие депрессии, угнетению когнитивных функций. Половая функция также ухудшается у обоих полов.
Осложнения и последствия
Самое страшное последствие хронической почечной недостаточности, сопровождающейся анемией – смерть пациента. Чем ниже гемоглобин, тем выше вероятность летального исхода. При несвоевременном выявлении анемии развиваются явления стенокардии, кровоточивость органов пищеварения, кровеносных сосудов. Важно отметить, что малокровие у детей негативно влияет на их развитие.
Тяжелым отдаленным последствием считается развитие сердечной недостаточности по причине гипоксии. Недостаток ферритина, низкий уровень сывороточного железа ведут к тому, что сердце усиливает выброс крови во время систолы, что ведет к гипертрофии миокарда, гипертонической болезни.
Читать также Лечение анемии народными средствами
Лечение дефицита железа у больных с ХПН
Если у пациента с почечной недостаточностью отмечается феррум-дефицит, лечение заключается в назначении препаратов, направленных на восстановление депо этого элемента. Обычно они прописываются в таблетированной форме. При поражении органов пищеварения их вводят парентерально.
Подкожное введение эритропоэтина способствует улучшению качества жизни пациентов с малокровием на фоне заболевания почек в составе комплексной терапии.
Анемии хорошо поддаются лечению этим препаратом за счет воздействия на один из этапов патогенетической цепочки.
Здесь важным моментом является то, что передозировка лекарственным средством грозит такими осложнениями, как гипертензия и тромбозы.
Терапия анемии при ХПН включает железосодержащие лекарственные средства, фолиевую кислоту, витамин В12. Иногда при гемодиализе врачи уходят от таблетированных препаратов, отдавая предпочтение внутривенному или внутримышечному их введению.
Состояние пациента значительно улучшается после аллотрансплантации почки, но такой шаг допустим только при пересадке органа от близких родственников при полной антигенной совместимости. Такие больные находятся на пожизненном наблюдении нефролога и трансплантолога.
Клинические эффекты препаратов Эпоэтина
Введение Эпоэтина альфа, Эпоэтина бета хорошо стимулирует формирование эритроцитов. Улучшаются такие показатели крови, как ретикулоциты, гемоглобин, гематокрит. Скорость захвата железа клетками растет. Средство не влияет на лейкопоэз.
При онкологических заболеваниях крови встречается эритропоэз, сопровождающийся внутрикостномозговым гемолизов, в связи с чем наступление клинического эффекта запаздывает на 2-3 недели, либо же не наступает вообще.
Показания и противопоказания к лечению Эпоэтином
Препарат рекомендован к введению при наличии у пациентов анемии различной природы:
- при заболеваниях почек;
- при онкологических процессах на фоне химиотерапии, в том числе при поражении костного мозга;
- лимфомы;
- миеломная болезнь;
- при аутогемотерапии;
- профилактика малокровия у недоношенных деток.
Целевой гемоглобин и этапы лечения Эпоэтином
Эффектами введения этого лекарственного вещества является рост гемоглобина с гематокритом. Улучшается работа всех органов и тканей за счет снижения явлений гипоксии. Лечение препаратом подразумевает две стадии:
- начальная, проводится коррекция малокровия;
- поддерживающая для стабилизации состояния пациента.
Врачи рекомендуют держать уровень гемоглобина не ниже 110 г/л, поскольку анемичным синдромом является снижение этого показателя ниже обозначенной цифры.
Читать также Препарат Фенюльс в лечении анемии
Выбор схемы введения Эпоэтина и препаратов железа
Определение дозы эритропоэтина, а также коррекцию лечения определяет исключительно врач. Для лечения анемии при хронической почечной недостаточности вводится препарат внутривенно медленно, в течение двух минут. Целью лечения считается достижение уровня гематокрита не менее 30%, при этом он не должен расти больше чем на 0,5% за 7 дней.
Стадия коррекции подразумевает подкожное введение препарата трижды за неделю по 20 МЕ/кг массы тела. Доза увеличивается при недостаточном росте гематокрита.
Важно отметить, что суммарное количество лекарственного средства допустимо за один прием в неделю. Максимальной дозой считается 720 МЕ/кг за 7 дней.
Поддерживающая терапия анемии при ХПН подразумевает двукратное снижение дозировке при нормальном уровне гематокрита.
Железосодержащие лекарственные средства предпочтительнее назначать в таблетках по причине того, что железо усваивается в просвете кишечника. Рекомендованной дозой является 80-100 мг за сутки.Лечение продолжается до тех пор, пока не восстановится нормальный уровень гемоглобина, а показатель сывороточного железа не будет находиться у верхней границы нормы.
Но здесь важно не допустить передозировки.
Причины снижения ответа на препараты Эпоэтина
Эффективность назначения эритропоэтина доказана для лиц всех возрастов, в том числе у пожилых, старых пациентов и маленьких деток. Данные многоцентровых исследований подтверждают наличие хорошего ответа на лечение этим лекарственным средством. За 4 месяца наблюдений уровень гемоглобина при тяжелых почечной анемии поднимался на 20 единиц.
Сниженный ответ на введение таких лекарственных средств наблюдался при выявлении других причин снижения гемоглобина – выраженном железодефиците, недостаточности витамина В12, фолиевой кислоты или при наличии хронических неустановленных геморрагий. Это обусловлено тем, что препараты эритропоэтина не способны повлиять на эти патогенетические звенья.
Побочные эффекты эритропоэтина
Среди побочных эффектов лекарственного средства отмечаются нижеприведенные.
- Развитие или усугубление артериальной гипертензии, а также возможное появление гипертонических кризов с осложнениями – нарушения сознания, выраженные головные боли, головокружения, дезориентация в пространстве.
- Тромбоз, тромбоэмболические явления.
- Усугубление течение ишемических процессов, усиление явлений стенокардии.
- Развитие парциальной красноклеточной аплазии.
- Снижение количества тромбоцитов, особенно часто такое состояние встречается при внутривенном введении эритропоэтина.
Среди лабораторных показателей отмечается увеличение концентрации калия и фосфатов крови. Количество ферритина и железа падает, но растет гематокрит. Иногда отмечаются такие аллергические реакции, как:
- зуд кожных покровов с высыпаниями, вплоть до крапивницы;
- при индивидуальной непереносимости развивается анафилактический шок.
Другие виды побочных эффектов – головные боли по типу мигрени, гипертермия, ознобы, боли суставов, покраснение кожи в месте введения эритропоэтина.
Источник: https://gemato.ru/anemiya/pri-xpn.html
Глава 4. Механизмы коррекции железодефицитной анемии у больных хронической почечной недостаточностью

Снижение гемоглобина крови менее 120 г/л считается анемией, длительное существование которой оказывает отрицательное влияние на различные системы организма, и в первую очередь на сердечно-сосудистую, приводя к расширению левого желудочка сердца (гипертрофия левого желудочка) и ремоделированию стенки сосудов.
Такие изменения индуцируют развитие различных осложнений, обуславливающих летальные исходы у 5096 больных, которые лечатся гемодиализом или перитонеальным диализом. Смертность от сердечно-сосудистых осложнений у молодых больных, находящихся на заместительной терапии, в десятки раз превышает летальность в общей популяции (рис. 1).
Анемия наблюдается приблизительно у 2596 больных хроническими заболеваниями почек еще в доазотемической стадии и почти у 10096 пациентов с хронической почечной недостаточностью (ХПН), и в ее происхождении ведущую роль отводят нарушению продукции функционально и морфологически скомпрометированными почками эритропоэтина (ЭПО).
Одной из основных причин анемии является дефицит железа в организме, обусловленный недостаточным его потреблением и постоянными кровопотерями (оккультные желудочно-кишечные кровотечения, кровопотери при пунктировании артериовенозной фисгулы, забор крови для нередко излишних анализов), укорочением жизни эритроцитов, связанным с состоянием субуремии, потерями ряда водорастворимых витаминов, влияющих на кроветворение, неадекватным лечением (рис. 2).
Поводом для увеличения продукции эндогенного ЭПО является недополучение органами кислорода (гипоксия), необходимого для энергетического обеспечения процессов метаболизма (обмена веществ).
В почках ЭПО продуцируется интерстициальными макрофагами, область локализации которых в ткани почек подвергается фиброзным (рубцовым) изменениям при ХПН.
В силу этого степень продукции ЭПО не соответпвует тяжести анемии.
Рис 1. Нормальное кроветворение. Достаточное количепво эритроцитов.
Рис 2. Кроветворение у пациента с ХПН. Недостаточное образование эритроцитов. Введение рчЭПО.
Широкое клиническое применение ЭПО стало возможным с 1986- 1987 гг., когда появился созданный на основе генно-инженерной технологии рекомбинантный человеческий ЭПО (рчЭПО), практически не отличающийся от эндогенного 300. рчЭПО больным с ренальной анемией вводят подкожно или внутривенно, причем первый путь является предпочтительным, поскольку позволяет корригировать анемию вдвое
Рис 3. Кроветворение после введения рчЭПО. Увеличение выработки эритроцитов.
меньшими дозами препарата. Сроки достижения целевых значений гемоглобина (до120 г/л) и гематокрита (3696) при правильном применении рчЭПО не превышают обычно 3 мес. В отсутствие рчЭПО сроки коррекции существенно увеличиваются, а целевые значения практически недостижимы.
РчЭПО, как и эндогенный ЭПО, повышает число эритроцитов в циркуляции путем стимуляции превращения эритроидных предшественников эритроцитов в костном мозге в зрелые клетки и предупреждает преждевременную гибель эритроидных предшественников (апоптоз). Назначение рчЭПО позволяет корригировать анемию у 9796 больных, однако имеется ряд факторов, снижающих эффективность применения препарата.
В перечне важнейших причин, снижающих гемопоэтический ответ на рчЭПО, на первом месте стоит дефицит железа (рис. 3).
Ежедневно у взрослого человека обновляется 0,896 циркулирующих эритроцитов. Исходя из пропорции, что в 1 мл крови содержится 1 мг элементарного Fe, ежедневная потребность в железе составляет16-20 мг.
Как упоминалось, в желудочно-кишечном тракте абсорбируется всего 1 мг/сут железа.
Таким образом, основная потребность организма в железе удовлетворяется за счет реутилизации, причем эти процессы протекают достаточно интенсивно: 80-8596 железа из состарившихся и распадающихся эритроцитов возвращается в костный мозг в течение 2 нед.
В условиях стимулированного эритропоэза, например при назначении рчЭПО, потребность в железе увеличивается в 6 — 8 раз, что не восполняется мобилизацией железа из депо. Это вызывает относительный (функциональный) дефицит железа (рис. 4). Уменьшение запасов железа в депо характерно для абсолютного дефицита железа.
Рис 4. Железодефицитный эритропоэз. После введения рчЭПО необходимо введение в/в железа.
У 40-7096 больных с почечной недостаточностью, поступающих на заместительную почечную терапию, имеется дефицит железа. Отражением абсолютного дефицита железа у диализных больных является снижение концентрации ферритина сыворотки менее100 мкг/л (у здоровых (30 мкг/л), функциональный дефицит выявляется по уменьшению насыщения трансферрина железом (менее 2096.Наиболее быстрый путь восполнения дефицита железа — его внутривенное введение. В России практически единственным препаратом железа, предназначенным для внутривенного введения, является Венофер (компания Вифор (Интернэшнл) Инк.
, Швейцария), представляющий собой железа(111) гидроксид сахарозный комплекс, в котором атом железа окружен большим количеством молекул сахарозы, что обеспечивает стабильность комплекса и предупреждает высвобождение большого количества свободного железа в циркуляцию, что может оказывать токсический эффект.
Препарат выпускается в ампулах по 5 мл, содержащих в каждой по100 мг железа. Максимальная разовая доза препарата Венофер равняется 500 мг при капельном способе внутривенного ввеДения.
В зависимости от степени дефицита железа выбирают различные схемы его коррекции, поддерживающая доза препарата составляет 100 мг в неделю или в 2 недели.
При соблюдении правил введения Венофер практически нетоксичен и не оказывает побочных эффектов, а данные фармакокинетики свидетельствуют, что от 61 до 9996 введенного внутривенно железа оказывается в костном мозге и в последующем в эритроцитах. Восполнение дефицита железа позволяет на 4096 уменьшить лечебную дозу рчЭПО (рис. 5).
Рис 5. Нормальный эритропоэз после введения в/в железа.
У больных с додиализной ХПН и больных на перитонеальном диализе после восполнения дефицита железа пополнение его запасов возможно посредством перорального назначения препарата Мальтофер производства компании Вифор (Интернэшнл) Инк., переносимость которого сущелвенно лучше, чем солевых препаратов железа.
Что, если у меня есть еще вопросы? Вам необходимо обратиться к Вашему доктору, который ответит на все Ваши вопросы. Серия Диализ без анемии включает следующие издания:
* Гемодиализ
*Анемия
* Дефицит железа — скрытая угроза здоровью
Page 3
Закладки Добавить
Источник: http://www.dr-denisov.ru/publ/58-1-0-229
Почечная анемия: симптомы и лечение. Способы лечения анемии у пациентов с хронической почечной недостаточностью

Развитие нефрогенной анемии или дефицитной, как ее еще называют, происходит вследствие уменьшения синтеза эритпротеинов
Развитие нефрогенной анемии или дефицитной, как ее еще называют, происходит вследствие уменьшения синтеза эритпротеинов. Эритропротеин — это белок, основная задача которого, регулировать и способствовать созреванию эритроцитов.
Для информации! В период внутриутробного развития плода эритропротеин вырабатывают почечные клетки.
В период взросления эритропротеин начинает самостоятельно синтезироваться почечными клетками. При снижении скорости фильтрации уровень образования также снижается, вследствие чего концентрация гемоглобина значительно падает. Такое нарушение влечет за собой не полное выведение из организма вредных продуктов обмена и препятствует процессу синтезирования эритропротеина.
Для информации! Нарушение кислотно-основного равновесия сокращает в два раза жизнедеятельность эритроцитов, а впоследствии их полностью разрушает.
В период прогрессирования почечной недостаточности терминальной стадии пациентам назначается процедура гемодиализа. Чрезмерные и необоснованные сдачи крови для анализов влекут за собой образование анемии.
Процесс развития почечной недостаточности завершающей или финальной стадии препятствует усвоению из продуктов пищи фолиевой кислоты и железа, которые являются основой для образования эритроцита. Дефицит полезных веществ в организме и несвоевременное их восполнение, также способно вызвать анемию.Стоит отметить, существуют определенные заболевания, вызывающие образование почечной недостаточности:
- поликистоз почек;
- гипертоническая патология;
- сахарный диабет;
- пиелонефрит хронической формы;
- мочекаменные заболевания;
- подагра;
- амилоидоз;
- гломерулонефрит;
- красная волчанка системная.
Симптомы и вред почечной анемии
Патология сопровождается слабостью, появлением усталости
Как правило, симптомы анемии проявляются при хронических заболеваниях почек, в особенности, при уровне креатинина 308 мкмоль/литр. Патология сопровождается следующим симптомомкопмлексом:
Симптомы лекарственного поражения почек и лечение
- слабость, появление усталости;
- головокружение;
- появление бледного цвета кожного покрова и губ;
- общее недомогание, подавленное состояние.
Для информации! Анемия, спровоцированная любой почечной патологией значительно ухудшает работоспособность органов, всей системы и усложняет протекание болезни.
При наличии долгосрочной патологии почек нарушается функциональность всей системы, а также развиваются другие заболевания, способные привести к летальному исходу. Из опасных заболеваний могут развиться: сердечная недостаточность, желудочно-кишечное кровотечение, стенокардия, кровоизлияние в головной мозг.
Важно! Развитие тяжелой анемии у детей в раннем возрасте влияет на физическое и умственное развитие, а также нарушает функциональность других внутренних органов.
Диагностика заболевания
Диагностирование для подтверждения малокровия назначают при условии, что у мужчин уровень гемоглобина снизился до 130 г/литр, а у женщин до 120г/литр
Диагностирование для подтверждения малокровия назначают при условии, что у мужчин уровень гемоглобина снизился до 130 г/литр, а у женщин до 120г/литр. Для точного выявления уровня малокровия пациенты сдают следующие лабораторные анализы, которые позволяют определить тесты:
- количество В12 в плазме крови;
- уровень процентного насыщения железа, который позволяет установить насколько данное вещество задействовано в процессе образования гемоглобина;
- точное число ретикулоцитов, который отвечают за процесс образования эритроцитов;
- показатель эритроцитов для дифференциальной диагностики;
- уровень запаса железа в организме.
Для информации! Уровень гемоглобина классифицируют по степени тяжести:
- легкая — уровень ниже нормы, но не менее 90 г/литр;
- средняя — уровень гемоглобина составляет 70-90 г/литр;
- тяжелая — уровень составляет не менее 70 г/литр.
В период выполнения диагностирования следует применять специальные методы, которые помогают выявить скрытые кровотечения. Как правило, кровотечения могут быть в желудочно-кишечном тракте или ректальные. В период менструального цикла женщинам рекомендуется пройти дополнительную консультацию у врача гинеколога.
Диагностические мероприятия
Для подтверждения диагноза следует сдать общий анализ крови.
Первый этап на пути диагностики почечной анемии — сдача общего анализа крови. На основании проведенного результатов теста определяют уровень гемоглобина в крови. При проведении диагностики важны показатели возраста и пола. Это важно учитывать при сопоставлении данных. Норма гемоглобина для женщин составляет 120 г/л, для мужчин — 130 г/л.
Для установления диагноза почечная анемия нужно сдать пробу на содержания в крови эритроцитов, железа и алюминия. Чтобы исключить скрытые кровотечения в организме, больным назначают анализ кала.
Женщинам, которые отмечают у себя признаки обильных менструаций, обязательно необходимо провести осмотр у гинеколога, и в случае необходимости нормализовать гормональный фон.
Источник: https://GolovaNeBoli.ru/pochki/pochechnaya-anemiya-pri-pochechnoj-nedostatochnosti.html
Способы лечения анемии у пациентов с хронической почечной недостаточностью | Советы доктора
Проблема хронической почечной недостаточности (ХПН) была и остаётся насущной и актуальной не только в пределах нефрологии, но и во многих других разделах медицины.
ХПН вылечить нельзя, но можно повысить качество жизни пациента, чем, в принципе, и занимается современная медицина.
Летальность больных ХПН остаётся на высоком уровне, даже несмотря на обилие качественных и эффективных методов заместительного лечения – гемодиализ, трансплантация. Возросло количество людей, находящихся в терминальной стадии заболевания.
Вместе с ХПН пациента настигает и тяжёлая анемия, которая протекает параллельно основному заболеванию. При этом состояние пациента ухудшается ещё больше.
Причиной такого нелицеприятного соседства служит снижение эритропоэтина из-за воздействия продуктов распада вследствие ХПН. Эритропоэтин способствует продукции эритроцитов, которые содержат гемоглобин и обеспечивают газообменную функцию крови.
Также на развитие анемии влияет укорочение жизни эритроцитов, однако это не определяющий фактор.
При ХПН клетки, из которых формируются эритроциты, в костном мозге подвергаются разрушению до достижения созревания. Кроме того, частые кровотечения из-за нарушения тромбоцитарной функции приводят к постгеморрагической анемии.
Характер анемии при ХПН чаще нормоцитарный и нормохромный, а если развивается недостаточность поступления железа, то и гипохромный. Эритропоэтин не будет вырабатываться в больших количествах при возрастании степени тяжести анемии, так как это является особенностью при ХПН.
Одними из важных отягчающих факторов после формирования ХПН являются заболевания сердца и сосудов, приводящие нередко к летальному исходу. Гипоксия, развивающаяся на фоне анемизации крови, приводит к нарушению тонуса сосудов.
Развивается дилятация, то есть расширение просвета сосудов, сопротивление его уменьшается и происходит падение артериального давления.
В этот момент происходит включение механизмов вазоконстрикции: частота сердечных сокращений увеличивается, ударный объём также становится больше, включается более активно в работу симатическая периферическая нервная система.
Во время такой реакции происходит сужение почечных артерий, что приводит к снижению и так уже сниженной клубочковой фильтрации в почках. Наступает ишемия почек. Жидкость задерживается в организме. Повышается объём плазмы крови, что ведёт к гипертрофическим изменениям в миокарде левого желудочка, ухудшению имеющейся сердечной недостаточности, развитию осложнений.
Больные, находящиеся на процедуре гемодиализа в половине случаев имеют гипертрофированную сердечную мышцу левого желудочка, что повышает риск развития острого коронарного синдрома, инфаркта миокарда и тяжёлых аритмических состояний. С этих моментов начинается формирование застойной сердечной недостаточности. Тесная связь анемии, ХПН и сердечной недостаточности была доказана несколько лет назад в крупных исследованиях с высокой доказательной базой.Чем тяжелее анемия при ХПН, тем хуже состояние пациента. Назначенные препараты при анемии на ранних этапах позволяли улучшить качество жизни больного в несколько раз.
Методы медикаментозного лечения
В 1985 году впервые был применен препарат группы эритропоэтинов.
Многочисленные исследования доказали, что применение эритропоэтина при снижении его в организме при ХПН способствует стимуляции костного мозга, а точнее препараты эритропоэтина представляют собой гликопептиды высокой очистки со средней молекулярной массой.
Различают эпоэтины нескольких типов: ЕРО ? и ?, ЕРО ?, ЕРО ?. Каждый из них воздействует на сугубо свой участок костного мозга стимулируя строго определённые его структуры.колониеобразующих единиц эритропоэза, и продукции достаточного количества эритроцитов и гемоглобина.
Эритропоэтины начали широко использоваться в медицинской практике с 1989 года. Препарат Эральфор наиболее интересен.
Это лекарственное средство является стимулятором гемопоэза рекомбинантного эритропоэтина человека. Форма выпуска препарата только парентеральная в виде внутривенного и подкожного введения.
Действиями препарата называются улучшение созревания эритроцитов, активация цитоза, стимуляция эритропоэза.
При введении Эральфона в организм человека происходит увеличение гемоглобина и гематокрита, улучшается кровоснабжение тканей и работа сердца становится более эффективной.
Наибольший эффект показал Эральфон при использовании его у пациентов с анемией на фоне ХПН.
Эффективность препарата практически не зависит от способа введения, однако при введении внутривенно доза его может быть снижена практически на 20%, что приводит к уменьшению финансовых затрат на лечение.Лечение эритропоэтинами проходит в две стадии:
- Начальный. Здесь предполагается коррекция, имеющейся анемии.
- Поддерживающий, когда назначают поддерживающие дозировки лекарственного средства.
Назначение Эральфона осуществляется 2-3 раза в неделю, так как препарат достаточно долго выводится из организма. Эральфон рекомедован пациентам в гемодиализный и додиализный периоды, а также пациентам на программном диализе после пересадки почки.
Не стоит забывать и об уровне железа в организме больных ХПН. При его недостатке назначаются препараты железа при анемии. Они могут быть использованы одновременно с эритропоэтинами, однако нужно учитывать, что оба препарата действуют как синергисты.
Кроме того, Эральфон может использоваться и для лечения анемии у пациентов с солидными опухолями, вирусом иммунодефицита человека, миеломной болезнью, ревматоидным артритом, лимфолейкозом.
При лечении Эральфоном необходимо проводить мониторинг артериального давления и количества тромбоцитов в крови, содержание гемоглобина, уровень ферритина и гематокрита. В связи с гипотензивным эффектом препарата пациентом с артериальной гипертензией может потребоваться пересмотр дозировки лечения в сторону её повышения.
Лекарственный препарат Эральфон эффективно и достоверно повышает выживаемость пациентов с хронической почечной недостаточностью, поднимает уровень качества жизни, причём является достаточно безопасным средством.
- Анастасия
- Распечатать
Источник: https://creacon.ru/?p=1816