Миеломная болезнь почек
Содержание
Поражение почек при множественной миеломе
Множественная миелома (миеломная болезнь) – заболевание, относящееся к парапротеинемическим лейкозам. Характеризуется неопластической трансформацией моноклонального В-лимфоцита в плазматическую клетку, вырабатывающую избыточное количество Ig или фрагментов Ig (парапротеина).
Поражения почек при множественной миеломе имеет различные механизмы.
Гиперпродукция легких цепей иммуноглобулинов (белок Бенс-Джонса) сопровождается протеинурией, которая оказывает прямое токсическое действие на канальцы и приводит к внутриканальцевой обструкции вследствие образования цилиндров.
Развивающиеся метаболические нарушения – гиперкальциемия и гиперурикемия – вызывают констрикцию сосудов почек, отложения фосфата кальция и уратов и усиливают обструкцию канальцев.
Сопутствующий амилоидоз является причиной отложения амилоида в клубочках и канальцах, но поражение клубочков умеренное. Более выраженные гломерулярные поражения возможны при интрамембранозных или субэндотелиальных депозитах парапротеина.
Симптомы
Самый частый симптом – боли в костях – выявляется у 70% больных. Боли локализуются в ребрах и позвоночнике и провоцируются движениями. Возможно развитие патологических переломов.
Компрессионные переломы позвонков могут привести к сдавлению спинного мозга. При рентгенографии выявляют крупные костные очаги в ключицах, грудине, и особенно в черепе.
Очаги четко очерчены (“пробойниковые”), реактивный остеосклероз вокруг них отсутствует.
Поражение почек выявляют у половины больных, но клинические симптомы мало выражены. Характерна медленно прогрессирующая почечная недостаточность. При обезвоживании у больных множественной миеломой может развиться острая почечная недостаточность. Заболевание носит прогрессирующий характер.
В крови выявляют нормохромно-нормоцитарную анемию, часто повышено содержание азота мочевины, креатинина и мочевой кислоты. У трети больных отмечается гиперкальциемия. У некоторых больных уменьшается анионная разница.
В моче повышается содержание белка – результат избытка парапротеинов. Проба с использованием мочевых индикаторных полосок не всегда позволяет обнаружить белок Бенс-Джонса.
Необходимо проведение пробы с сульфасалициловой кислотой.
Лечение
Специфического лечения почек не существует. Но объективное улучшение состояния и продление жизни больных возможно при проведении химиотерапии (мелфалан или циклофосфамид) в сочетании с глюкокортикостероидами, тщательной регуляции ОЦК и электролитного статуса.
Циклофосфамид применяют курсами по 150–500 мг/сут в/в или 400–500 мг внутрь в течение 4 дней каждые 3–4 недели или непрерывно по 150 мг/сут.
Мелфалан назначают в виде повторных курсов (0,25 мг/кг/сут в течение 4 дней каждые 4–6 недель) или непрерывного приема в дозе 0,08–0,14 мг/кг/сут в течение первых 8–10 дней и 0,03 мг/кг/сут в дальнейшем.
Одновременно назначают преднизолон повторными короткими курсами (1 мкг/кг/сут в течение 4 дней каждые 6 недель). Оба препарата вызывают лейкопению, поэтому дозы следует подбирать индивидуально.
Для предупреждения развития функциональной почечной недостаточности больные должны получить достаточное количество воды с целью обеспечения диуреза > 2000 мл/сут.
При выраженной гиперкальциемии показано внутривенное введение большого количества изотонического раствора вместе с фуросемидом (до 1 л/ч в течение 8–12 ч) с последующим приемом внутрь преднизолона и препаратов фосфора.
Гиперурикемия, развивающаяся при множественной миеломе, ухудшает функцию почек, поэтому необходимо назначать аллопуринол внутрь по 300 мг/сут.Показан больным плазмаферез, способствующий освобождению крови от легких цепей иммуноглобулинов и уменьшению их синтеза и отложения в тканях, прежде всего в почках. Гемодиализ проводят также при эффективности лечения миеломы цитостатиками, так как при отсутствии эффекта этой терапии гемодиализ влияния на функцию почек не оказывает.
В последнее время для лечения миеломной болезни используются стволовые клетки. Однако трансплантация гемопоэтических стволовых клеток не отменяет иные методы лечения. Пересадка имеет возрастные ограничения – ее можно применять при лечении пациентов до шестидесяти, редко до семидесяти лет.
У пациента во время ремиссии, достигнутой благодаря лекарственной терапии и которая может длиться несколько месяцев, берут его собственные стволовые клетки. Их хранят в специальном биохранилище при температуре до минус 196 градусов. Все это время идет процесс подготовки пациента к трансплантации. Потом ему возвращают его собственные гемопоэтические клетки.
Увеличивается продолжительность и качество жизни пациента, возвращается трудоспособность.
Источник: http://medicoterapia.ru/porazhenie-pochek-pri-mnozhestvennoy-mielome.html
Множественная миелома. Питание при миеломе и продолжительность жизни
Что это такое: миелома (от греч. «миелос» – костный мозг, «ома» – общее название любых опухолей) – онкологическое заболевание крови, злокачественная опухоль, растущая в костном мозге. Иногда эту болезнь ошибочно называют «раком».
Опухоль состоит преимущественно из плазмоцитов – клеток, отвечающих за иммунитет, борьбу с инфекционными заболеваниями, выработку иммуноглобулинов. Эти клетки произрастают из В-лимфоцитов, но при различных нарушениях процесса их созревания появляются опухолевые клоны, которые и ведут начало миеломы.
Злокачественные образования миеломы инфильтруют костный мозг трубчатых костей, поражая их.
Размножение плазмобластов и плазмоцитов в костном мозге способствует синтезу парапротеинов – аномальных белков, иммуноглобулинов, которые в данном случае не выполняют свои защитные функции, но их повышенное количество сгущает кровь, повреждает различные внутренние органы.
Заболевание дифференцируют по иммунохимическим признакам принадлежности белков (иммуноглобулинов) к одному из классов. Например, появление белков класса IgE определяет наличие Е-миеломы.
Виды миеломы
Различают несколько вариантов миеломной болезни.
Солитарная форма – это единичный очаг инфильтрации, чаще всего сосредоточенный в плоских костях.
Генерализованная форма подразделяется на:
- Диффузную миелому (поражение костного мозга);
- Диффузно-очаговую миелому (поражение и других органов, например, почек);
- Множественную миелому (образование опухолевых инфильтраций по всему организму).
Также миеломы отличаются между собой составом клеток опухоли:
- Плазмоцитарная;
- Плазмобластная;
- Полиморфно-клеточная;
- Мелкоклеточная.
Существуют различные иммунохимические признаки секретируемых парапротеинов:
- Миелома Бенс-Джонса (так называемая болезнь легких цепей);
- Миеломы A, G и M;
- Несекретирующая миелома;
- Диклоновая миелома;
- Миелома М.
В 70% случаев встречается миелома G, в 20% случаев – миелома A, чуть реже (15%) миелома Бенс-Джонса.
Стадии болезни
Течение болезни можно разделить на три стадии:
- I — стадия начальных проявлений;
- II — стадия развернутой клинической картины;
- III — терминальная стадия;
Стадия I – бессимптомный период, в течение которого не наблюдается клинических признаков и изменений в состоянии пациентов.
Стадия II – при которой наиболее четко выражены все клинические симптомы, характерные для миеломы.
Стадия III – терминальная. Происходит распространение миеломы в различные внутренние органы.
Существуют подстадии А и В характеризующиеся наличием или отсутствием у пациента почечной недостаточности.
Проявления и симптомы
Зачастую миелома развивается, не привлекая особого внимания, проявляясь болью в костях. В результате развития болезнь распространяется на внутренние части плоских костей (лопаток, грудины, позвонков, черепа) или эпифизы трубчатых костей.
Нередки случаи обнаружения миелосаркомы – злокачественных элементов, в основном состоящих из клеток белого кровяного ростка.
В дальнейшем на костях появляются образования в виде округлой мягкой субстанции, – это характерно для диффузно-узловатой миеломы (миелобластома), при этом разрушается костная ткань.
https://www.youtube.com/watch?v=LH3SB2FeBp8
Бывают случаи, когда болезнь незаметна до определенного периода и внезапно появляется спонтанный перелом – последствия остеодиструкции.
Выявляются нарушения работы желудочно-кишечного тракта, ухудшение зрения, непостоянная температура тела, общая слабость, анемия, частные инфекционные заболевания: от обычного гриппа до лейкоплакии вульвы или шейки матки.
В результате поражения внутренних органов, появляются неприятные ощущения и боли, сердцебиение, чувство тяжести в подреберье. Бывает, что миеломные узлы сдавливают головной мозг, возникают головные боли.
Кроме того, возможны патологические изменения позвоночных дисков, приводящие к миелорадикулоишемии, нарушению кровоснабжения спинного мозга.
Причины заболевания. Факторы риска
Причины развития миеломы достоверно неизвестны. Можно выделить лишь общие факторы, способствующие проявлению онкологических заболеваний в целом.
Довольно часто миелома обнаруживается у людей пожилого возраста (старше 65 лет), людей, подвергающихся воздействию какого-либо ионизирующего излучения, имеющих длительный контакт с продуктами нефтепереработки, асбестом и другими токсическими веществами.
Некоторую роль в появлении миеломы играют расовая принадлежность, вирусные инфекции, стресс и генетическая предрасположенность.
По статистике среди темнокожего населения миелома встречается почти вдвое чаще, чем среди белокожих наций, однако причину такого распределения до сих пор не смогли выявить.Большую роль в изучении причин возникновения миеломы играет генетическое исследование, имеющее возможность обнаружить гены, способные своими мутациями вызвать опухоль.
Диагностика
Для диагностики миеломы применяются лабораторные методы исследования.
Наиболее характерные изменения можно выявить на основе общего анализа крови и мочи, обратив внимание на следующие показатели: повышенное сверх нормы содержание кальция в моче или в сыворотке крови, вместе с тем высокий уровень белка в моче и низкое количество эритроцитов, тромбоцитов и гемоглобина, увеличенная до 80 мм/ч. и выше СОЭ. Высокое содержание общего количества белка в крови на фоне низкого уровня альбумина.
Более точный диагноз дает определение моноклональных парапротеинов, исследование мочи на белок Бенс-Джонса. Положительный анализ дает наличие легких цепей парапротеинов, проходящих сквозь канальцы почек.
Кроме этого проводят ряд других исследований: рентгенографию, томографию костей, трепанобиопсию костного мозга, цитогенетические исследования, определяют количественные показатели иммуноглобулина в крови.
Проведение единичного анализа недостаточно для верной диагностики, поэтому для окончательного результата исследований необходимо сопоставить все данные с клиническими проявлениями признаков заболевания.
Лечение
Лечение миеломы проводит в стационаре врач-гематолог. Миелома относится к неизлечимым поражениям кроветворных тканей, полное исцеление от которой возможно только при трансплантации костного мозга, но правильное и своевременно назначенное лечение позволяет держать опухоль под контролем.
Этапы курса лечения миеломы:
Основную часть комплекса по лечению миеломы занимает химиотерпия. Кроме того, применяют и другие новые виды лечения, основываясь на правильном прогнозе заболевания. При бессимптомном течении болезни стадии IА или IIА лечение откладывают, но за пациентом постоянно наблюдают, контролируют состав крови. Если стадия заболевания перешла в развернутую, назначают цитостатики и химиотерапию.
Получите смету на лечение
* Только при условии получения данных о заболевании пациента, представитель клиники сможет рассчитать точную смету на лечение.
Показания для химиотерапии:
- Анемия;
- Гиперкальциемия (повышение уровня содержания кальция в сыворотке крови);
- Амилоидоз;
- Гипервискозный и геморрагический синдром;
- Поражение костей;
- Поражение почек.
Различают два вида химиотерапии: стандартную и высокодозную. Применяются как давно известные препараты «Мелферан», «Сарколизин», «Циклофосфан», так и новые, более современные, «Карфилзомиб», «Леналидомид», «Бортезомиб».
Для лечения пациентов, возраст которых превышает 65 лет, применяют «Преднизолон», «Винкристин», «Алкеран», «Циклофосфан». Они же используются при наиболее агрессивной форме заболевания.
При костной миеломе применяют также бифосфонаты («Бонефос», «Аредия», «Бондронат»), тормозящие разрастание самой миеломы, подавляющие активность остеокластов и способные останавливать разрушение костной ткани.
Пациентам младше 65 лет после курса стандартной химиотерпии возможно назначение высокодозной химиотерапии, вплоть до трансплантации стволовых клеток (своих или донора).Лучевая терапия применяется в основном при поражении костей с сильным болевым синдромом и крупными очагами разрушения ткани, при солитарной миеломе, а также у слабых пациентов как паллиативный метод лечения. Как дополнение к лечению назначают «Дексаметазон».
В качестве поддерживающей терапии пациентам в состоянии ремиссии назначают в высоких дозах альфа2-интерферон в течение нескольких лет.
Профилактика и лечение осложнений основана на коррекции функции почек при почечной недостаточности, применении мочегонных средств, диеты, празмафереза (очищение крови от парапротеинов) или гемодиализа в более тяжелых случаях, переливания компонентов крови при анемии. Кроме того, подавления инфекционных заболеваний применением антибиотиков (как правило широкого спектра действия), дезионтоксикационную терапию.
Большое внимание уделяется нормализации содержания кальция применением мочегонных средств, кальцитрина. Различные степени гиперкальциемии лечат гидратацией, употреблением минеральной воды, инфузиями. При переломах применяют остеосинтез, вытяжение, оперативное лечение.
Трансплантация костного мозга
Трансплантация костного мозга из-за высокого риска осложнений (в особенности у пациентов старшего возраста) на данный момент не находит широкого применения при лечении миеломы. Наиболее приемлемый вариант – трансплантация стволовых клеток от донора или же самого пациента, способная привести к излечению приблизительно у 20% пациентов.
Оперативное хирургическое лечение миеломы применяют при поражениях позвоночника, сдавлениях корешков нервов, сосудов, других жизненно важных органов или проводят укрепление и фиксацию костей при переломах.
Диета и питание
Питание при миеломе исключает пирожные, конфеты, борщи и другие жирные, острые, соленые и копченые продукты. Также нежелательны сдобные мучные продукты, пшено, перловка, ржаной хлеб, бобовые, молоко цельное и кисломолочные продукты, соки, газированные напитки и квас.
Питаться нужно небольшими порциями. При нормальном уровне лейкоцитов, в рацион можно вводить яйца, рыбу, нежирную говядину, мясо кролика, курицы, печень. Каши из круп, подсушенный хлеб. Допускаются фрукты и овощи в свежем или отварном виде.
При пониженном количестве сегментоядерных лейкоцитов в крови (нейтрофилов) и диспептических проявлениях в рацион питания можно включать каши из риса на воде или рисовый суп.
Желательно употреблять пищу, содержащую кальций, витамины В и С, с количеством белков до двух грамм на килограмм веса в сутки. При химиотерапии и нормальной работе почек количество употребления жидкости составляет до трех литров. Можно пить компоты, кисель, чай, отвар шиповника.
Например, при химиотерапии на завтрак можно съесть хлеб с маслом, омлет на пару или запеканку из манной крупы, чай зеленый, кофе. В обед – говяжьи котлеты, приготовленные в пароварке, нежирный суп на мясном бульоне, подсушенный хлеб, компот. В перерыве между обедом и ужином можно выпить ягодный кисель, съесть печенье (сухое). На ужин отварное нежирное мясо, рисовый гарнир, отвар шиповника.
Продолжительность жизни при миеломе
В зависимости от формы заболевания и его течения, от стадии, на которой началось лечение, прогнозы по продолжительности жизни пациента различаются от считанных месяцев до десятка лет.
Обусловлено это также ответом болезни на лечение, наличием других патологий, возрастом пациентов.
Кроме того, при миеломе развиваются, приводящие к летальному исходу, тяжелые осложнения: почечная недостаточность, сепсис, кровотечения, поражение внутренних органов применением цитостатиков.
Продолжительность жизни в среднем, при условии проведения стандартной химиотерпии – 3 года. При высоких дозах химических препаратов – 5 лет.У людей с повышенной чувствительностью к химиотерапии продолжительность жизни не превышает 4 лет.
При длительном лечении химическими препаратами не исключено развитие вторичной устойчивости миеломы, которая трансформируется в острый лейкоз. Миелома имеет высокий уровень злокачественности, полное излечение наблюдается очень редко.
При стадии IА продолжительность жизни в среднем составляет около пяти лет, при стадии IIIВ – менее 15 месяцев.
: Миелома
Источник: https://pro-rak.com/zlokachestvennaya-opuhol/mieloma/
Миеломная нефропатия: причины, диагностика и лечение
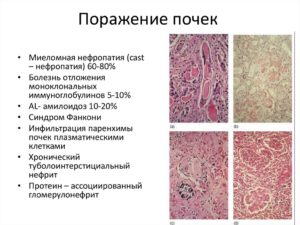
Миеломной нефропатией называется смертельное заболевание, характеризующееся поражением почек. Ткани органа уплотняются, приобретают ярко-красный оттенок, почки увеличиваются в размерах.
Последствием заболевания становится прогрессирующая почечная недостаточность, избавиться от которой невозможно. Кроме того, заболеванию сопутствует атеросклероз сосудов. При своевременно начатом лечении удается продлить срок ремиссии и качество жизни пациента.
В группе риска – люди пожилого возраста. Нефропатия в данном случае – проявление миеломы, злокачественного онкологического заболевания, для которого характерно появление множественных опухолевых разрастаний во всем организме.
Этиология
Заболевание характеризуется поражением почечных канальцев и гломерул, вызванным миеломой. Последняя является раковым заболеванием, суть которого продуцирование костным мозгом большого количества клеток плазмы.
Таким образом, основной причиной нефропатии является миеломная болезнь. Раковые клетки выделяют в кровь патологический белок Бенс-Джонса, откладывающийся на поверхности почек и провоцирующий рубцевание тканей органа.
На первых этапах болезни, при условии, что почки пациента здоровы, белковые молекулы проникают в отверстия почечных мембран. Здесь они окисляются и сворачиваются. Появившиеся в ходе этого токсины блокируют функцию гломерул почки.
В результате в последней повышается давление, а ее работоспособность ухудшается. Спустя время по причине высокого внутрипочечного давления происходит замещение тканей органа соединительной тканью, вследствие чего наступает дисфункция почки.
Помимо этого, под воздействием окисленного белка происходит нефроз (то есть повреждение почки) поскольку ее фильтрация невозможна из-за заблокированных почечных канальцев.
Клиническая картина
Заболевание характеризуется сложностью диагностики, что связано с отсутствием специфических и явных признаков миеломной нефропатии. При заболевании прогрессирует функциональная почечная недостаточность (она становится причиной смерти в 30%), которая, однако, почти не имеет симптоматики.
Показательным симптомом является протеинурия, то есть присутствие белка в моче. Это может быть одна из ее форм: мини- или макропротеинурия. Последняя встречается чаще – уровень белка в моче может достигать 50-60 гр/л.
Иногда протеинурия обнаруживается даже без клинического анализа мочи – по шапке пены в урине. Однако этот признак не всегда означает протеинурию. Кроме того, в моче присутствуют небольшие следы крови. Идет речь о микрогематурии.
Клиническая картина дополняется симптоматикой, характерной для миеломной болезни:
- Боли в костях.
- Остеопороз.
- Повышенная хрупкость костей, частые переломы.
- Гиперкальцемия (то есть увеличение количества содержания кальция в крови)
- Деформация костей, приводящая к изменениям скелета, уменьшению роста пациента.
- Частые инфекционные заболевания бактериальной этиологии,
- Анемия.
В редких случаях пациент страдает отечностью. Его артериальное давление имеет тенденцию снижаться по мере прогрессирования рака.
Методы диагностики
Первейшим способом диагностики является анализ мочи на содержание в нем белка. При положительном результате задача дальнейших исследований – дифференциация рассматриваемого недуга и гломерулонефрита.
Показательными должны стать отсутствие у пациента в прошлом стафилококковых и стрептококковых инфекций и обострений гломерулонефрита. В таком случае врач может заподозрить нефропатию, этиологически связанную с миеломой.
«Беспричинная» протеинурия, повышение количества лейкоцитов в крови и необъяснимая анемия, особенно у лиц старше 35-40 лет, должны стать поводом задуматься о наличии у пациента миеломной нефропатии.
Для установки диагноза должны быть проведены 3 типа диагностики:
- Электрофорез мочи (выявляет белок Бенс-Джонса в урине)
- Определение в крови и урине парапротеинов.
- Стернальная пункция, благодаря которой определяется уровень клеток плазмы.
Пункционная биопсия почек используется крайне редко. В первую очередь по причине малой информативности. Несмотря на то что биопсия позволяет исключить гломерулонефрит и амилоидоз, морфологические изменения органа могут быть многообразными.
Это, в свою очередь, не дает повода вести речь исключительно о развитии нефропатии на фоне миеломы. Во-вторых, данный способ диагностики сложен с точки зрения выполнения, имеется риск смерти пациента.
Прогноз
Заболевание имеет неблагоприятный прогноз. Лечение зависит от степени тяжести поражения, эффективность цитостатической терапии, скорости прогрессирования почечной недостаточности. В ходе лечебных мероприятий удается увеличить продолжительность жизни пациента до 5-10 лет и добиться стойкой ремиссии.
При этом в 60% после проведенной цитостатической терапии диагностируется острый лейкоз. Основные причины летального исхода – смерть от инфекции, острой почечной недостаточности.
Профилактика
Единственным профилактическим мероприятием можно назвать регулярные профилактические медосмотры, обращение к специалистам при первых признаках заболевания.
Добиться продолжительной ремиссии позволит соблюдение предписаний врача.
Загрузка…
Источник: https://KardioBit.ru/pochki/lechenie/mielomnaya-nefropatiya
Миелома: что это за болезнь, признаки миеломы крови, стадии миеломы, сколько живут

Миелома — злокачественная опухоль, подавляющая нормальное кроветворение, разрушающая кости и вырабатывающая патологические белки, повреждающие внутренние органы. Когда говорят о миеломе крови или костей, или позвоночника, или костного мозга, то имеют ввиду одно заболевание с разнообразными проявлениями.
Относящееся к гемобластозам или онкогематологическим процессам, то есть злокачественным болезням крови и лимфатической ткани заболевание имеет много названий: множественная миелома, миеломная болезнь и генерализованная плазмоцитома, плазмоцитарная миелома.
Причина миеломы
Миелома состоит из изменённых плазматических клеток. В нормальном костном мозге плазматические клетки рождаются из В-лимфоцитов, но число их ограничено всего 5%, большее количество — уже патология.
Определённой ясности с первопричиной развития плазматической опухоли нет, в инициации процесса подозревают плохую наследственность и склонность к аллергии против собственных тканей, радиацию и работу с токсичными веществами, под подозрение попал и вирус герпеса 8 типа.
Правда, достоверных доказательств участия всего перечисленного в злокачественном перерождении не представлено. Ясно одно, что-то помешало нормальному созреванию В-лимфоцитов или вмешалось в многоэтапный путь от их «детства» до лимфатической зрелости, из-за чего-то лимфоцит превратился в дефектный плазмоцит, давший начало миеломе.
Миеломная болезнь поражает трёх из 100 тысяч россиян, как правило, пожилых — преимущественно на седьмом десятке жизни, у молодых до 40 лет заболевание встречается очень редко.Среди страдающих заболеваниями крови и лимфатической ткани плазмоцитому имеет 10-13%, но из всех существующих в природе злокачественных процессов на больных плазмоклеточной опухолью приходится не более одного процента.
Что происходит при миеломе?
По какой-то причине в костном мозге появляются ненормальные клетки, размножаясь, они нарушают нормальное кроветворение, что проявляется анемией. Недостаток эритроцитов сказывается на работе всех органов, но особенно сильно на легочной ткани и головном мозге, что проявляется недостаточностью их функций.
Функция нормальных плазматических клеток — выработка антител-иммуноглобулинов для защиты от болезнетворных агентов. Миеломные плазмоциты тоже вырабатывают иммуноглобулины, но дефектные парапротеины, не способные к иммунной защите.
Вырабатываемые злокачественными плазмоцитами парапротеины откладываются в тканях органов, излюбленное «место складирования» — почки, в которых развивается «болезнь лёгких цепей» с исходом в почечную недостаточность.
В поражённой печени снижается выработка разжижающих кровь веществ — повышается вязкость крови, нарушающая обменные процессы в тканях, образуются тромбы.
Отложения иммуноглобулинов наносят урон и другим органам, но не столь фатальный.
В костях миеломные клетки стимулируют остеокласты, вызывая остеолизис — разъедание кости. Из разрушенной кости кальций выходит в плазму, накапливаясь, приводит к гиперкальциемии — тяжёлому состоянию, требующему принятия срочных мер.
Записьна консультациюкруглосуточно
Диагностика миеломной болезни
Диагноз устанавливается по анализам крови, где находят парапротеины и определяют их суммарную и видовую концентрацию. Парапротеины обозначают как иммуноглобулины — IgA, IgG и IgМ. Плазмоциты вырабатывают иммуноглобулины по собственному усмотрению и в разном количестве, по их изменению продукции патологических белков впоследствии оценивают эффективность лечения и активность заболевания.
Степень агрессивности плазматических клеток выясняют при микроскопии костного мозга, его получают из грудины при стернальной пункции или при биопсии тазовой кости. Особенно актуально исследование при невысокой продукции парапротеинов или при изменении характера течения болезни.
Давний маркёр заболевания — белок Бенс-Джонса в моче, выявляемый у 70% пациентов. Белок формируется из цепочек иммуноглобулинов А и G небольшого молекулярного веса — «лёгких», которые просачиваются из почечных канальцев. По содержания Бенс-Джонса тоже контролируют течение болезни.
Часто заболевание случайно обнаруживается во время обычной рентгенографии органов грудной клетки по литическим дефектам ребер. На первом этапе необходимо выявить все деструктивные изменения в костях, чтобы в дальнейшем следить за процессом и результатами терапии, что позволяет высокочувствительная низкодозная КТ всего скелета.
При МРТ изучается состояние плоских костей — черепа и таза, что обязательно при тлеющей и солитарном варианте опухоли. МРТ помогает оценить не только дефекты кости, но и наличие опухолевой инфильтрации мягких тканей, вовлечение в процесс спинного мозга.Обязательно проводится анализ на кариотип для выявления генетических аномалий, влияющих на прогноз в отношении жизни больного и эффективность лечения.
Когда диагноз миеломы не вызывает сомнений
Характерные особенности клеток определяют течение процесса от медленной и практически доброкачественной гаммапатии или тлеющей миеломы до стремительного плазмоклеточного лейкоза.
Не всегда изначально удаётся классифицировать заболевание, что усложняет выбор оптимальной терапии. В 2014 году международный консенсус определил критерии, облегчающие постановку точного диагноза и отделяющие один вариант опухолевого процесса от других.
В первую очередь, в костном мозге определяют процент плазматических клеток, так при симптоматической миеломной болезни их должно быть более 10%, а 60% говорит о высокой агрессивности опухоли.
Для каждого варианта заболевания предусмотрены определенные количественные характеристики и сочетания критериев, так для полной убеждённости в наличии у пациента миеломы необходимо обнаружить специфические «продукты»:
- М-протеин в крови, то есть IgA или IgG;
- легкие цепи иммуноглобулинов;
- в моче белок Бенс-Джонса;
- очаги в костях скелета.
При недостаточности специфических критериев диагностике помогают неспецифические, но часто встречающиеся последствия деятельности плазмоцитов и парапротеинов на органы-мишени:
- повышение уровня кальция крови в результате массивного разрушения костей;
- снижение гемоглобина при опухолевом замещении костного мозга;
- повышение креатинина крови — маркёра почечной недостаточности.
Симптомы миеломы
Замечено, что каждый пул плазматических клеток производит иммуноглобулины с персональными особенностями и по своему графику, отчего клинические проявления очень своеобразны и глубоко индивидуальны.
Нет двух одинаковых больных, тем более невозможно найти двух похожих пациентов по диагностическим критериям. Тем не менее, выделяют несколько типов заболевания.
По количеству поражений опухоль может быть генерализованной или множественной и солитарной — с единственным очагом.
По течению различают вялотекущую или тлеющую, она же индолетная, и симптоматическую плазмоцитому, протекающую с явными клиническими проявлениями.
Основное проявление симптоматической миеломы — боли в костях вследствие их разрушения, которые появляются не сразу и часто даже не в первый год заболевания.Болевой синдром возникает при вовлечении в опухолевый процесс надкостницы, пронизанной нервными окончаниями.
При медленно текущем процессе до выявления опухоли может пройти несколько лет, поскольку ничего кроме эпизодов слабости у пациента не возникает.
В развёрнутой стадии с множественными поражениями на первый план выходят в разных комбинациях и с индивидуальной интенсивностью переломы в местах деструкции костей и проявления почечной недостаточности, или амилоидоз органов.
Лечение миеломной болезни у молодых
Вялотекущий вариант миеломной болезни не всегда требует лечения, поскольку не угрожает жизни, а терапия совсем не безвредна. В данном случае наблюдение за течением процесса более выгодно пациенту, нежели токсичная химиотерапия. Регулярные обследования позволяют вовремя диагностировать активизацию процесса.
Симптоматическая миелома разделяется по стадиям от I до III по уровню в крови специфического микроглобулина и альбумина, стратегия при стадии I и II-III различается только используемыми препаратами и их комбинациями.
При любой стадии основное и определяющее тактику — состояние пациента и его возраст. Так сохранным больным до 65-летнего возраста и без тяжёлых хронических болезней предлагается агрессивная химиотерапия высокими дозами с пересадкой собственных стволовых клеток крови, по-научному, аутологичной трансплантацией.
Физически сохранные пациенты от 65 до 70-летия тоже могут претендовать на высокодозную химиотерапию, но уже не комбинацией лекарств, а единственным препаратом — мелфаланом.
До начала высокодозной химиотерапии проводится несколько курсов полихимиотерапии обычными дозами, затем специальным препаратом стимулируется выработка костным мозгом собственных стволовых клеток, которые собираются и консервируются. Затем пациент получает очень высокие дозы цитостатиков, в результате чего гибнут все клетки крови — опухолевые и нормальные. Нормальные, заблаговременно законсервированные кровяные элементы и вводят пациенту.
Лечение миеломы у пожилых
Пациенты старше 65 лет и помоложе, но с сопутствующими болезнями, влияющими на общее состояние и активность, тоже на первом этапе проходят цикловую химиотерапию, в том числе с использованием таргетных препаратов.
Результат лечения оценивается по анализам крови и костного мозга, где определяют концентрацию специфических для заболевания белков и процент опухолевых клеток.
На результате лечения отражается не только возраст, но и наличие нескольких хронических болезней, астенизация, подразумевающая физическое ослабление с похуданием или без оного.
Астенизированного человека наши предки называли «квёлым». Такие пациенты рискуют не перенести агрессивного лечения, но достаточно неплохо отвечают на более легкие варианты противоопухолевой химиотерапии.
В последние годы спектр химиопрепаратов существенно расширился за счёт таргетных средств, продемонстрировавших хороший непосредственный результат и увеличение продолжительности жизни участников исследований.Поражения скелета подлежат длительной терапии бисфосфонатами, уменьшающими болевой синдром, предотвращающими переломы и гиперкальциемию. На отдельные опухолевые очаги воздействуют ионизирующим излучением, обязательна лучевая терапия при угрозе сдавления спинного мозга и поражении шейного отдела позвоночника.
Прогноз при миеломной болезни
Кроме возраста пациента и его физического состояния на прогнозе миеломы и продолжительности жизни отражается чувствительность опухоли к лекарственному лечению и биологические характеристики плазматических клеток, в частности генетические аномалии с делецией участков хромосом и амплификацией — удвоением генов.
Играет роль концентрация парапротеинов и их фракций, объем поражения на момент выявления болезни и степень вовлечения в патологический процесс других органов, так уже развившаяся почечная недостаточность «перевесит» все прочие благоприятные признаки заболевания.
Очень важно для жизни пациента правильно выбрать лечащего доктора и клинику, где могут провести точнейшее обследование и пациентом занимается целая команда врачей разных специальностей, знающих клинические проблемы немолодого миеломного больного и умеющих их решать.
Записьна консультациюкруглосуточно
Список литературы:
- Давыдов М.И., Аксель Е.М./ Статистика злокачественных новообразований России и странах СНГ 2007 г.//Вестник РОНЦ им. Н.Н. Блохина РАМН, 2009; 20 (3)
- Kyle RA, Rajkumar SV./ Criteria for diagnosis, staging, risk stratification and response assessment of multiple myeloma// Leukemia. 2009; 23(1)
- Durie BGM, Salmon SE. / A clinical staging system for multiple myeloma: Correlation of measure Myeloma cell mass with presenting clinical features, response to treatment, and survival// Cancer, 1975;36.
- Facon T, Mary JY, Hulin C et al./ Melphalan and prednisone plus thalidomide versus melphalan and prednisone or reduced intensity autologous stem cell transplantation in elderly patients with multiple myeloma (IFM 99-06): a randomised trial// Lancet 2007; 370
- Weber DM, Chen C, Nievisky R et al./ Lenalidomide plus dexamethasone for relapsed multiple myeloma in North America.// N Engl J Med 2007; 357.
Источник: https://www.euroonco.ru/mieloma
Миеломная нефропатия
Что касается патогенеза миеломной нефропатии, то он заключается прежде всего в повреждении почечных нефронов патологическими
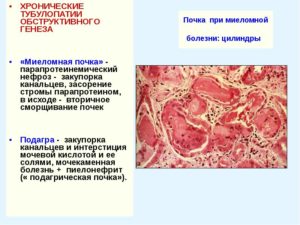
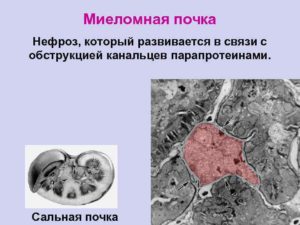
(аномальными) белками – парапротеинами. Учитывая это, миеломная нефропатия по своему происхождению рассматривается как классический пример “нефроза выделения” (Г. А. Алексеев, 1970). Специфическим для истинной миеломной почки считается отложение преципитатов патологических миеломных белков в дистальных отделах канальцев с закупоркой и повреждением последних.
При этом синтезируемые миеломными клетками микромолекулярные белки Бенс-Джонса поступают в ток крови, достигают почек и легко проходят через неповрежденный клубочковый фильтр.
В просвете канальцев, где жидкость имеет кислую реакцию, профильтровавшиеся в клубочках белковые массы свертываются, образуя большое количество цилиндров, приводящих к обтурации просвета дистальных отделов канальцев.
В результате повышается внутриканальцевое давление в вышележащих (проксимальных) отделах канальцев с расширением их просвета и развитием так называемого интрареналъного гидронефроза (нефрогидроза).
Кроме того, частично реабсорбированные канальцевым эпителием патологические белки проникают в интерстициальную ткань, вызывая отечность почечной стромы, застой лимфы с возникновением лимфоцитарных инфильтратов, т. е. воспалительного процесса в интерстициальной ткани (интерстициалъный нефрит). В дальнейшем развиваются гиалиноз и склероз интерстиция с последующей гибелью клубочков, нефронов и нефротическим сморщиванием почек. Повреждение канальцев может обусловить развитие нефротического синдрома.
Все другие поражения ночек, обнаруживаемые при миеломной болезни, имеют неспецифический характер. Так, в результате присоединения инфекции может возникнуть пиелонефрит. Примерно у 5-25 % больных развивается амилоидоз почек. Метаболические нарушения нередко приводят к развитию не только интерстициального нефрита, но и нефрокальциноза и уролитиаза.
Течение болезни Миеломная нефропатия
Макроскопически почки при миеломной нефропатии увеличены в размерах, плотноватой консистенции, интенсивно-красного цвета. На разрезе выбухает отечный мозговой слой. В отдельных случаях почки могут быть уменьшены в размерах и сморщены.
Гистологически основные изменения обнаруживаются в дистальных отделах канальцев. Наиболее характерно для миеломной почки обилие цилиндров в расширенных просветах канальцев, в отдельных участках – с отложением кальция (известковые цилиндры). Появление этих цилиндров связано с преципитацией белка Бенс-Джонса.
В ряде случаев большинство канальцев заполнено гомогенными белковыми массами. Иногда цилиндры характерной чешуйчатой формы по периферии окружены гигантскими клетками типа клеток рассасывания инородных тел.
Эпителий канальцев подвергается значительным изменениям в виде гиалиново-вакуольной, вакуольной и зернистой дистрофии, легко слущивается.
Эти изменения эпителия развиваются преимущественно в проксимальных отделах канальцев, где осуществляется реабсорбция белка Бенс-Джонса, который, как полагают, может оказывать прямое повреждающее действие на эпителиальные клетки. В отдельных случаях находят отложения парапротеинов в клубочках, интерстициальной ткани и вокруг сосудов.
Однако необходимо отметить, что почечные клубочки при миеломной нефропатии почти не подвергаются патологическим изменениям, за исключением тех случаев, которые сопровождаются развитием амилоидоза. В интерстициальной ткани выявляются (не менее чем в 50 % случаев) участки фиброза и клеточных инфильтратов.
Сосуды почек, как и клубочки, при истинной миеломной почке остаются практически интактными. При выраженной и длительной гиперкальциемии развивается нефрокальциноз и образование конкрементов (примерно в 10 % случаев).
Поскольку миеломная болезнь развивается преимущественно у лиц пожилого возраста, нередко обнаруживаются явления атеросклероза сосудов почек и с этим связывают возможность развития ишемии почек. Отмечающиеся в дальнейшем нарушения лимфо- и кровообращения приводят к гибели нефронов и развитию нефросклероза с клинической картиной ХПН.Необходимо отметить, что у отдельных больных независимо от тяжести клинических и лабораторных проявлений миеломной нефропатии в почках не обнаруживается существенных изменений.
Симптомы болезни Миеломная нефропатия
Клиническая картина миеломной нефропатии характеризуется значительным многообразием. Это зависит как от характера патологических изменений со стороны почек, так и от симптомов поражения других органов и систем, главным образом костной системы.
Наиболее ранним и постоянным признаком миеломной почки является протеинурия, которая обнаруживается у 65-100 % больных. Выраженность ее колеблется в широких пределах – от следов белка до 3,3-10 г/л, а иногда она достигает 33 г/л и даже 66 г/л.
Известны случаи, когда упорная, стойкая протеинурия была единственным симптомом миеломной болезни на протяжении многих лет. Иногда протеинурия может задолго предшествовать появлению других симптомов этой болезни. В подобных случаях заболевание долго протекает под маской хронического гломерулонефрита с изолированным мочевым синдромом.
С помощью электрофореза белков мочи (из суточного ее объема) на бумаге или в крахмальном геле, а также иммуноэлектрофореза удается установить микромолекулярную (белок Бенс-Джонса) природу миеломного уропротеина в виде моноклонового пика (“М”-градиента), подобно аналогичному пику на электрофореграмме белков сыворотки крови.
Уропротеин Бенс-Джонса электрофоретически выявляется в моче у 95 % больных миеломной болезнью (Г. А. Алексеев, 1970). Поэтому в каждом случае протеинурии неясной этиологии, особенно у лиц пожилого возраста, как правило, необходимо проводить электрофорез белков мочи, т. е. исследовать уропротеинограмму.
Для уропротеинограммы больных миеломной нефропатией в отличие от протеинурии другого происхождения характерно преобладание глобулинов над альбуминами с наличием “пика глобулинурии”. Учитывая сказанное, качественная характеристика белков мочи с помощью упомянутых методов имеет исключительно эажное диагностическое значение.
Для миеломной нефропатии характерно обнаружение в моче белка Бенс-Джонса. Однако при обычном исследовании путем нагревания мочи до 50-60 °С белок Бенс-Джонса выявляется лишь у 30-40 % больных.
Между тем нахождение его имеет не только диагностическое, но и прогностическое значение, поскольку стойкое наличие этого белка в моче может свидетельствовать о скором развитии необратимой почечной недостаточности.
Белок Бенс-Джонса составляет основную массу белков мочи и суточная его экскреция может достигать 20 г и более (И. Е. Тареева, Н. А. Мухин, 1986). В осадке мочи постоянно обнаруживаются гиалиновые цилиндры, реже – зернистые и эпителиальные, а в случае присоединения пиелонефрита выявляется лейкоцитурия.
Гематурия не характерна для миеломной почки, и лишь в редких случаях отмечается незначительная эритроцитурия (3-10 эритроцитов в поле зрения). Примерно у 1/3 больных наблюдаются фосфатурия и щелочная реакция мочи.Отеки, артериальная гипертензия и изменения со стороны сосудов глазного дна не характерны для миеломной нефропатии и обычно отсутствуют, даже при развитии почечной недостаточности.
Артериальное давление, как правило, не повышается и имеет тенденцию к снижению по мере прогрессирования болезни.
Отеки возможны лишь в тех редких случаях, когда миеломная нефропатия проявляется в виде амилоидоза почек с нефротическим синдромом.
Клинически миеломная нефропатия протекает в виде своеобразного “нефроза выделения” с относительно быстро (подостро) развивающейся почечной недостаточностью, которая проявляется полиурией, снижением клубочковой фильтрации, гиперазотемией, заканчиваясь летальным исходом вследствие азотемической уремии.
Почечная недостаточность при миеломной болезни встречается у 20-40 % больных и расценивается как вторая по частоте причина смерти этих больных (после инфекционных осложнений). Развитию почечной недостаточности обычно предшествует более или менее длительная протеинурия с наличием примерно у 1/з больных белка Бенс-Джонса.
Интересно отметить, что при отсутствии в моче этого белка почечная недостаточность не развивается даже при выраженной и продолжительной протеинурии.
Б механизме развития почечной недостаточности, помимо белка Бенс-Джонса, который оказывает нефротоксическое действие на канальцевый эпителий, существенное значение имеют обтурация просвета канальцев (тубулярная обструкция), а также такие факторы, как гиперкальциемия, гиперуриекемия, повышенная вязкость плазмы крови, нефрокальциноз и развитие в отдельных случаях плазмоцитариых инфильтратов.
Протеинурия и хроническая почечная недостаточность – наиболее частые и характерные проявления миеломной нефропатии. Другие почечные синдромы и симптомы встречаются реже (острая почечная недостаточность, нефротический синдром, синдром Фанкони).В некоторых случаях как начальное проявление миеломной нефропатии может развиться ОПН. Причины ее возникновения различные: чаще всего в результате блокирования канальцев белковыми преципитатами либо кристаллизации кальция (нефрокальциноз).
Например, описаны случаи развития ОПН у больных миеломной болезнью непосредственно после внутривенной (экскреторной) урографии, которая проводилась для уточнения причины протеинурии неясного генеза. ОПН в таких случаях протекает очень тяжело и в основном заканчивается летальным исходом.
Поэтому при подозрении на миеломную болезнь, а тем более при уже установленном диагнозе этого заболевания экскреторная урография таким больным противопоказана.
Нефротический синдром, как уже отмечалось, при миеломной болезни встречается редко и обычно является результатом присоединения амилоидоза.
В ряде случаев, когда миеломная нефропатия протекает с тяжелым поражением канальцев, развивается выраженная дисфункция последних с нарушением их парциальных функций. В результате могут появляться глюкозурия, аминоацидурия, фосфатурия, гипокалиемия и гипостенурия, т. е. признаки, характерные для синдрома Фанкони, который нередко осложняет течение миеломной болезни.
ечение миеломной нефропатии, как и самой миеломной болезни, хроническое, неуклонно прогрессирующее, с развитием хронической почечной недостаточности, которая примерно в 1/3 случаев является непосредственной причиной смерти.
При диффузных формах миеломной болезни с тотальным поражением костного мозга причиной летального исхода являются выраженная анемия и геморрагический диатез.
В других случаях летальный исход наступает при явлениях общей кахексии или вследствие осложнений, связанных с множественными переломами костей, – пневмонии при переломах ребер, уросепсиса в связи с компрессионными переломами позвонков.Средняя продолжительность болезни от начала ее первых клинико-лабораторных проявлений составляет 2-5 лет и лишь в отдельных неосложненных случаях достигает 6-10 лет (Г. А. Алексеев, 1970).
Диагностика болезни Миеломная нефропатия
Поставить диагноз миеломной нефропатии очень трудно, особенно в тех случаях, когда она является первым либо основным синдромом миеломной болезни. Поражение почек, сопровождающееся изолированной и стойкой протеинурией, часто протекает под маской гломерулонефрита, амилоидоза или пиелонефрита.
Прижизненная клиническая диагностика таких вариантов миеломной болезни весьма затруднена, а диагностические ошибки достигают 30-50 % (А. П. Пелещук, 1983).
Наличие при этом анемии и увеличение СОЭ вначале не находят должного объяснения, и лишь в поздней стадии болезни им ретроспективно дается правильная оценка.
О возможности миеломной почки необходимо думать и в тех случаях, когда протеинурия возникает как бы “беспричинно” (без предшествующей ангины, при отсутствии в анамнезе указаний на острый гломерулонефрит, хронические нагноительные заболевания и т. п.
) в сочетании с анемией, высокой СОЭ, особенно если такое сочетание наблюдается у лиц старше 40- 45 лет, при отсутствии отеков, артериальной гипертензии, гематурии и при наличии гиперпротеинемии и гиперкальциемии.
Диагноз более убедителен, если упомянутые признаки развиваются на фоне костной патологии, т. е. на фоне болей в костях.
Для уточнения диагноза необходимо исследовать мочу на белок Бенс-Джонса, провести рентгенографию костей (черепа, ребер, подвздошных, позвонков), электрофорез белков крови и мочи (с целью обнаружить специфическую для миеломной болезни “М” -фракцию или “М”-градиент) и наконец стернальную пункцию.
Что касается пункционной биопсии почки, то диагностическая ценность этого метода является спорной, поскольку морфологические изменения в почках при миеломной болезни характеризуются большим многообразием, и установить специфические признаки миеломной почки удается далеко не всегда.
В то же время пункционная биопсия почки позволяет исключить амилоидоз и гломерулонефрит.Хроническая почечная недостаточность, обусловленная миеломной почкой, в отличие от ХПН другой этиологии (в частности, гломерулонефрита) не сопровождается развитием артериальной гипертензии и гипокальциемией.
Уровень кальция в крови таких больных всегда повышен, в том числе и в стадии ХПН.
При развитии канальцевого ацидоза в крови повышается уровень натрия и хлора и снижается содержание калия, тогда как с мочой понижается суточная экскреция натрия, хлора, кальция, фосфора и повышается выделение калия.
Лечение болезни Миеломная нефропатия
До настоящего времени не существует надежных методов и. средств лечения миеломной болезни. Тем не менее применение комплексной терапии с использованием цитостатиков (сарколизин, циклофосфамид и др.
) в сочетании с глюкокортикоидами и анаболическими гормонами позволяет во многих случаях добиться длительной (до 2-4 лет) клинической ремиссии и, следовательно, увеличения продолжительности жизни больного, временного восстановления его физической активности и даже трудоспособности (у лиц, не занятых физическим трудом).
Однако цитостатики и глюкокортикоиды можно назначать лишь при отсутствии признаков почечной недостаточности. У больных миеломной нефропатией в стадии хронической почечной недостаточности применение этих препаратов противопоказано.
В таких случаях проводится симптоматическая терапия (как и при ХПН другой этиологии). Перитонеальный диализ и гемодиализ не рекомендуются. В отдельных случаях используют плазмаферез. Не показана таким больным и пересадка почки.
Для коррекции наблюдающейся при миеломной почке гиперкальциемии назначают кортикостероиды, диуретики, кальцитонин; рекомендуют обильный прием жидкости (в целях борьбы с дегидратацией и увеличения диуреза). При развитии гиперурикемии показан прием аллопуринола. Используют также введение дезинтоксикационных растворов, переливание крови и эритроцитарной массы.
К каким докторам следует обращаться при болезни миеломная нефропатия
Нефролог
Уролог
Гематолог
Источник: https://znaniemed.ru/%D0%B1%D0%BE%D0%BB%D0%B5%D0%B7%D0%BD%D1%8C/%D0%BC%D0%B8%D0%B5%D0%BB%D0%BE%D0%BC%D0%BD%D0%B0%D1%8F-%D0%BD%D0%B5%D1%84%D1%80%D0%BE%D0%BF%D0%B0%D1%82%D0%B8%D1%8F